- Accueil
- Electricité
- Batterie
- Batteries au plomb
Technologie des batteries au plomb

Pour les technophiles, voici des détails sur la technologie des batteries au plomb et de leurs variantes...
Petite histoire de l'accumulateur
Inventé en France
Inventé en 1859 par le français Gaston Planté, l'accumulateur au plomb se compose de deux feuilles de plomb, trempant dans de l'acide sulfurique dilué. Il s'agit du premier accumulateur rechargeable. Pendant la charge initiale nommée "formation" par Planté, les réactifs forment un amas fragile sur les plaques.
Peu pratique sous cette forme, l'accumulateur de Planté reste expérimental pendant une vingtaine d'années.
Développé au Luxembourg
En 1881, le luxembourgeois Henri Owen Tudor, reprend le principe de l'accumulateur Planté, et l'industrialise en introduisant des plaques de plomb coulé, enduites d'une pâte active. Beaucoup plus robuste, l'accumulateur ouvert tel que nous le connaissons est né.
La première usine d'accumulateurs Tudor est construite à Rosport (Luxembourg), puis devant le succès grandissant, la production est délocalisée en France et en Belgique, puis vers l'Allemagne et l'Angleterre.
Les frères Tudor sont aussi à l'origine du développement de la voiture électrique. Le château familial de Rosport fut la première demeure au monde, équipée d'une installation hydro-électrique complète.
Précautions d'emploi
Dégagements gazeux
Lors de la charge, une batterie au plomb ouverte libère de l'oxgène et de l'hydrogène dans les proportions exactes d'un mélange détonant. D'où la nécessité d'aérer son emplacement, et d'éviter flammes et étincelles.
Les bouchons doivent être ôtés pendant l'utilisation du chargeur.
Les boites à batterie fermées sont prohibées
Electrolyte
En raison de ses bouchons non étanches, une batterie ouverte doit être utilisée à plat, sinon l'électrolyte s'écoule et les plaques ne sont plus immergées.
La recharge provoque l'électolyse de l'eau, dont le niveau doit être complété régulièrement (eau distillée ou déminéralisée exclusivement, jamais d'acide !)
La surcharge augmente le dégagements, d'où les risques de débordement et perte d'acide.
Corrosion
Vapeurs et les projections d'acide sulfuriques sont corrosives. Il convient de neutraliser régulièrement l'emplacement de la batterie (eau + bicarbonate de soude).
Etat de charge
Il n'est pas simple de déterminer l'état de charge d'une batterie. Il faut la tester régulièrement
Une batterie au plomb doit toujours être maintenue chargée. Ne pas compter sur l'alternateur de bord pour recharger complètement une batterie déchargée.
Les batteries au plomb n'aiment pas rester déchargées !
Fin de vie
Une batterie au plomb s'use si l'on s'en sert. Et même si l'on ne s'en sert pas. On considère une batterie comme hors service quand elle a perdu 20 % de sa capacité nominale.
Une batterie est en fin de vie bien avant d'être incapable d'assurer le démarrage du moteur.
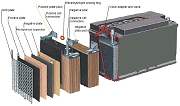
Constitution d'une batterie conventionnelle
Batterie ouverte
Les accumulateurs, ou éléments, sont groupés en série pour former une batterie au plomb. Les tensions individuelles s'additionnnent, ainsi que les résistances internes.
La tension à vide d'une batterie au plomb est d'environ 2 volts par élément.
Nos batteries comportent six éléments, leur tension nominale est de l'ordre de 12 Volts.
Si la tension au repos est inférieure à 11,5 Volts, la batterie est en fin de vie.
Plaques
Des plaques de plomb, en forme de grille pour la tenue mécanique, sont enduites de pâte active, et entrelacées. Dioxyde de plomb PbO2 de couleur brune pour les plaques positives, plomb spongieux de couleur grise pour les plaques négatives.
Séparateurs
Les plaques étant très proches, on les isole par des séparateurs isolants et poreux, souvent à base de cellulose.
Electrolyte
L'ensemble est plongé dans une solution d'acide sulfurique dilué (H2SO4), l'électrolyte. La densité de la solution est de 1,275 à 1,300 dans une batterie chargée.
Chaque élément dispose d'un bouchon permettant le remplissage, et le dégagement des gaz produits pendant la charge.
Les variantes
On distingue deux percées technologiques depuis la mise au point des premiers accumulateurs au plomb Tudor. Ces batteries restent toutefois des batteries au plomb, avec leurs particularité.
Les batteries au plomb n'aiment pas rester déchargées !
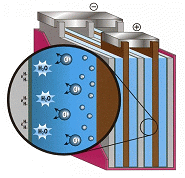
Batteries "au gel" :
Ou batteries gélifiées, ou gell-cell.
L'une des premières variantes apparues. L'électrolyte est immobilisé par un gel de silice, et le boîtier est fermé par des soupapes. L'acide risque moins de se renverser, la stratification est limitée.
Avantages : ce type de batterie supporte assez bien les décharges importantes (mais il faut recharger sans délai), on l'emploie pour la traction des fauteuils et chariots électriques.
Inconvénients : sous l'effet de la chaleur et des vibrations, il arrive que le gel se liquéfie. La résistance interne n'en favorise pas l'utilisation comme batterie de démarrage.
Pendant la charge, des microbulles apparaissent dans l'électrolyte, introduisant des vides dans le gel. En raison de l'immobilisation de l'acide, ces vides ne se comblent pas complètement à la recharge, et la surface d'échange diminue peu à peu.
La surcharge doit être évitée à tout prix.
Cette technologie n'a guère connu d'évolution récente. La résistance interne est un peu supérieure à celle des batteries RG, et les courants maximaux inférieurs.
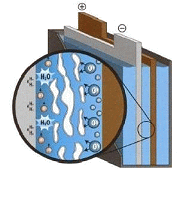
Batteries à recombinaison de gaz :
Beaucoup plus récentes, les batteries à recombinaison de gaz (RG) sont apparues il y a une vingtaine d'années. L'électrolyte humecte des séparateurs en microfibres de verre, qui aident au maintien des plaques. Le boîtier étanche est fermé par une soupape antidéflagrante.
Avantages : excellente capacité, fort courant de décharge (démarrage), très faible taux d'autodécharge, quasiment aucun dégazage. Ces modèles sont les plus résistants aux chocs et aux vibrations. Une batterie RG peut s'installer en toutes position.
Ce type de batterie est actuellement considéré comme le meilleur choix de batterie de démarrage
Inconvénients : ces batteries très techniques, supportent mal la sucharge, et s'accomodent mieux de chargeurs évolués.
Voir la page sur les batteries RG 
 Envoyer un message
Envoyer un message